知ってる? スマホも体も「原子」でできてる!
聞いてよ、みんな! 今使ってるスマホ も、今日食べた給食 も、いやいや自分の体だって、宇宙のすべての物はぜーんぶ “原子” って小さな粒々でできてるんだ!
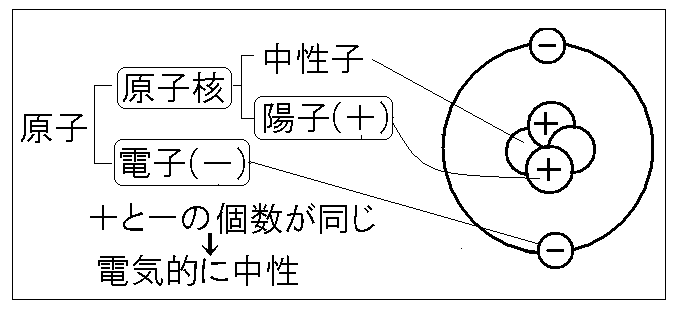
原子ってなんだ?
イメージとしては、原子って太陽系 みたいな感じ! 太陽系って、太陽 が中心にあって、その周りを地球 みたいな惑星がグルグル回ってるでしょ?
原子の場合は、中心にある太陽 が “原子核” で、プラスの電気を帯びた “陽子” と電気を持ってない “中性子” がぎゅっと集まってるんだ!
そして、原子核の周りを回る地球 が “電子” ! 電子はマイナスの電気を帯びていて、原子核の周りをすごいスピードでビュンビュン回ってるんだ! ️ふつう、陽子と電子の数は同じだから、原子全体で見るとプラスマイナスゼロで安定しています。
じゃ、イオンは何?
原子は時々イメチェンしちゃう時があるんだ! それが “イオン” !
例えば、原子は、陽子と電子の数は同じで、原子全体で見るとプラスマイナスゼロだけど、マイナスの電子が減って、原子全体とするとプラスになっちゃった状態が “陽イオン”。 おなじみの食塩 の成分、ナトリウムイオン(Na+)がまさにコレ!
ナトリウム原子(Na)は、陽子11個、電子11個でバランスとれてるんだけど、電子を1個失って陽子11個、電子10個で、全体として+1になって陽イオンのナトリウムイオン(Na+)に変身するんだ!
逆に、 “陰イオン” は、電子が増えてマイナスになっちゃった状態なんだ。
塩素原子(Cl)は、陽子17個、電子17個でバランスとれてるんだけど、他から電子を1個もらって、陽子は17個、電子は18個になって、原子全体ではマイナス1になって、陰イオンの塩化物イオン(Cl-)に変身するんだ!
陽イオンにしても、陰イオンにしても、減ったり増えたするのは必ず電子だけ。 陽子の方は、減ったり増えたりできません。

基礎ワードのまとめ
原子核:陽子(+)と中性子(電気を帯びない)で構成
電子:マイナスの電気を帯びて原子核の周りを回る
陽イオン:電子を失ってプラスの電気を帯びた原子
陰イオン:電子を得てマイナスの電気を帯びた原子
イオン同士がくっつく!?💖
プラスの陽イオン(+)とマイナスの陰イオン(-)は、まるで 磁石のN極とS極みたいに引き寄せ合ってくっつく 性質があるんだ!🧲
しかもただくっつくだけじゃない! なんと、お互いの電気を打ち消し合って、全体として プラスマイナスゼロの安定した状態 になる。 この陽イオンと陰イオンがくっついてできる結びつきのことを 「イオン結合」 って言うんだ!
基本のイオンを覚えよう
水素イオン
水素イオン: H⁺
ナトリウムイオン
ナトリウムイオン: Na⁺
銅イオン
銅イオン: Cu²⁺ 銅イオンがある水溶液は青色
マグネシウムイオン
マグネシウムイオン :Mg²⁺
亜鉛イオン
亜鉛イオン: Zn²⁺
バリウムイオン
バリウムイオン: Ba²⁺
アンモニウムイオン
アンモニウムイオン: NH₄⁺
水酸化物イオン
水酸化物イオン: OH⁻
塩化物イオン
塩化物イオン: Cl⁻
硫酸イオン
硫酸イオン: SO₄²⁻
硝酸イオン
硝酸イオン: NO₃⁻
炭酸イオン:
炭酸イオン: CO₃²⁻
動画でまとめ
イオンの結びつき方 化学式の書き方:
イオン結合は、+イオン(陽イオン)と-イオン(陰イオン)が結びついて、全体として電気的に中性(±0)になるように結びつきます。
基本的なルール
① +イオンと-イオンが結びつく
② 結びついた結果、全体として電気的に中性(±0)になります。
③ できた物質の化学式では、+イオンを前に、-イオンを後ろに書きます。
④ それぞれのイオン(原子)の個数を右下に小さく書きます。
次の化学式をイオンの結びつき方のルールに沿って考えてください。
塩化ナトリウム
⇒ ナトリウムイオン(Na⁺)1個 と 塩化物イオン(Cl⁻)1個で、±0
⇒ +イオンを前に、-イオンを後ろに書くから、化学式は NaCl です。
硫酸ナトリウム
⇒ ナトリウムイオン(Na⁺) と 硫酸イオン(SO₄²⁻)で、±0にするのは、(Na⁺)2個と(SO₄²⁻)2個が結合。
⇒ +イオンを前に、-イオンを後ろに書き、(Na⁺)2個は、Naの右下に書くから、化学式は Na₂SO₄ です。
水酸化カルシウム
⇒ カルシウムイオン(Ca²⁺) と 水酸化物イオン(OH⁻)で、±0にするのは、(Ca²⁺)1個と(OH⁻)2個が結合。
⇒ +イオンを前に、-イオンを後ろに書き、水酸化物イオン(OH⁻)2個は、OHの右下に書くから、化学式は Ca(OH)₂ です。
※注意 OHは1つの塊で、OHが2個あるから、数学のように( )を使って(OH)₂と書く。
OH₂と書くと、Oが1個で、Hが2個になる。
まとめ
イオン結合は+イオンと-イオンが電気的に中性になるように結びつく現象です。化学式を書くときは、+イオンを前に、-イオンを後ろに書き、各イオンの数を右下に小さく書きます。これにより、イオン結合の結果できた化合物の構造と成分が明確になります。
理解度確認テスト
- イオン結合が起こる理由は何ですか?
a) 同じ電荷だから
b) 異なる電荷だから
c) 電荷を持たないから
d) 化学反応が起こるから - ナトリウムイオン(Na⁺)と塩化物イオン(Cl⁻)が結びつくと、できる物質は何ですか?
a) Na₂Cl
b) NaCl₂
c) NaCl
d) Na₂Cl₂ - 硫酸ナトリウムの化学式はどれですか?
a) NaSO₄
b) Na₂SO₄
c) Na₃SO₄
d) Na₂S₂O₄ - 水酸化カルシウムの化学式はどれですか?
a) CaOH
b) Ca(OH)₂
c) Ca₂OH
d) CaOH₂ - イオン結合で陽イオンはどこに配置されますか?
a) 前
b) 後
c) 真ん中
d) どこでもよい - 陰イオンの位置はどこに配置されますか?
a) 前
b) 後
c) 真ん中
d) どこでもよい - 塩化ナトリウムの化学式は何ですか?
a) Na₂Cl
b) NaCl₂
c) NaCl
d) Na₂Cl₂ - カルシウムイオン(Ca²⁺)が結びつく陰イオンの数は?
a) 1
b) 2
c) 3
d) 4 - イオンの数を書く位置はどこですか?
a) 左上
b) 右上
c) 左下
d) 右下 - Na⁺とCl⁻が結びつく理由は何ですか?
a) 同じ電荷だから
b) 異なる電荷だから
c) 電荷を持たないから
d) 化学反応が起こるから
解答
① b ② c ③ b ④ b ⑤ a
⑥ b ⑦ c ⑧ b ⑨ d ⑩ b
😊「なんだ。簡単じゃん」と感じてもらえたらすごくうれしいです。わかりにくい問題があったら、教えてください。簡単に説明したり、わかりやすい他の方法で、もっと楽に理解が深まります。
「ブログより実際に話しがしたい」「もっといろいろ教えてほしい!」と感じた人は、無料体験や相談に来てください! この先生に相談をすることや習うことができます! 少し勇気を出して、ぜひ一度体験しに来てください! 「わかるって面白い」とか成績が良くなる自分を感じられる日がきます。お問い合わせ・ご質問はこちらです。












