電池のヒミツ!スマホも動かす力の源を探れ!
みんな、こんにちは! マックスです。
毎日使ってるスマホやゲーム機。 その中にも「電池」があって、電気を流しています! 今回は、そんな電池の仕組みを、わかりやすく解説するよ!
金属の個性:イオンになりやすさランキング!
金属には、それぞれ「イオン化傾向」っていう個性があって、電子を放出してプラスイオンになりやすい順番が決まっているんだ。 ランキング形式で見てみよう!
[イオン化傾向ランキング] 左側の方がイオンになりやすい!電子を手放しやすい!
(右側の方が、イオンから原子に戻りやすい!)
Na > Mg > Al > Zn > Fe > (H) > Cu
<ナニ。 マジ ある 亜鉛 鉄 (H) 道>
って覚えちゃうと忘れにくいよ!
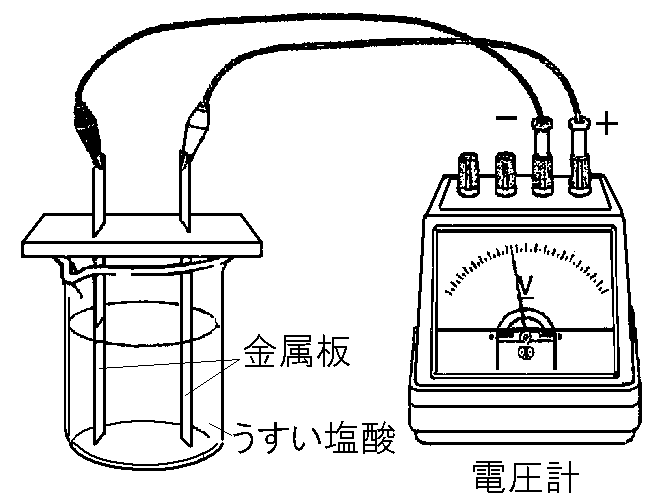
実験スタート!亜鉛と銅で電池を作ってみよう!
じゃあ、実際に亜鉛板と銅板を使って電池を作ってみよう!
- 亜鉛板と銅板を電解質溶液(イオンを含む液体)に浸す。
- イオン化傾向ランキングで、亜鉛は銅より左側、つまりイオンになりやすい!
- なので、亜鉛は電子を手放して亜鉛イオン(Zn²⁺)になって溶液の中に溶け出すんだ!
- 手放された電子は亜鉛板に残って、亜鉛板はマイナスの電気を帯びるから「ー極(負極)」になるよ!
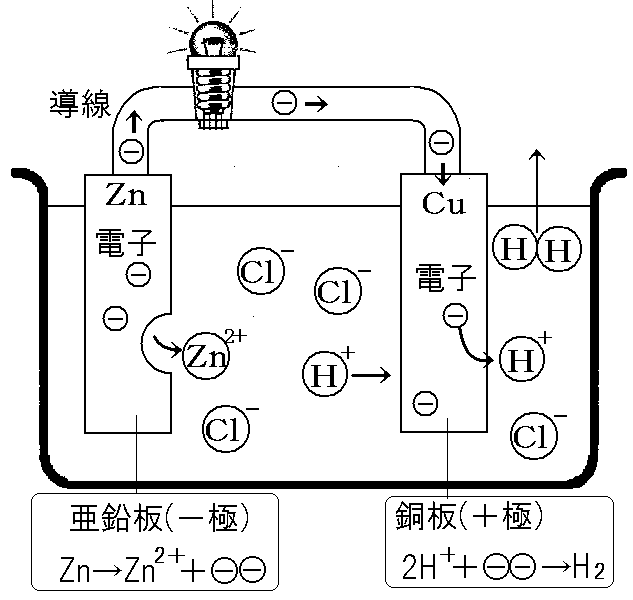
電子の旅路:イオン化傾向が低い方に移動!
- 亜鉛板に溜まった電子は、導線を通って銅板まで移動するんだ!
- 銅板にたどり着いた電子は、溶液中の水素イオン(H⁺)と出会う!
- 実は、電解質溶液には亜鉛イオン(Zn²⁺)もいるんだけど・・・
- 電子は、イオン化傾向が低い方に移動する性質があるんだ!
- つまり、水素イオン(H⁺)の方が亜鉛イオン(Zn²⁺)より電子を受け取りやすい!
- 結果、水素イオン(H⁺)が電子を受け取って水素原子(H)になり、2個くっついて水素分子(H₂)として発生するんだ!
電池の仕組み:イオン化傾向の違いで電気が発生!
このように、イオン化傾向の違う金属を使うことで、電子の流れが生まれて電気が発生するんだ!
亜鉛板と銅板の電池では、
- 亜鉛板:Zn → Zn²⁺ + 2e⁻
- 銅板:2H⁺ + 2e⁻ → H₂
- 全体:Zn + 2H⁺ → Zn²⁺ + H₂
という反応が起きているんだね!
電池の力をもっと知るためのポイント!
- イオン化傾向の差が大きい金属ほど、電圧は大きくなるよ!
- 電解質溶液には、イオンが存在する酸、アルカリ、食塩水などが使われるよ!
- 同じ金属では電圧が発生しないので、電池として機能しないんだ!
今回は、電池の仕組みを簡単に解説したけど、もっと深く学びたい人は、ぜひ教科書や参考書を読んでみてね!
身の回りの電化製品がどんな電池で動いているのか、調べてみるのも面白いかも
イオン化傾向と電池の原理 理解度チェック!
問題
① 次の金属をイオン化傾向の大きい順に並べ替えよ。
Cu, Zn, Mg, Fe
② イオン化傾向が大きいとは、どのような性質を持つことか説明せよ。
③ 亜鉛板と銅板を電解質溶液に浸した電池で、銅板付近では気体が発生する。この気体は何か?
④ 亜鉛板と銅板を用いた電池において、電子はどちらの電極からどちらの電極に流れるか。
⑤ 電池の電圧は、使用する金属のどのような性質によって決まるか。
⑥ 電池に食塩水を使う場合、どのようなイオンが電解質溶液中に存在するか。
⑦ イオン化傾向が異なる金属を接触させて電解質溶液に浸すと、電流が発生する。この装置を何というか。
⑧ イオン化傾向の小さな金属は、原子に戻りやすいですか。戻りにくいですか。
⑨ 水素イオン(H⁺)よりもイオン化傾向の小さい金属は、酸に溶けて水素を発生させるか。
⑩ 電池の仕組みを簡単に説明せよ。
⑪ 電池に使われる電解質溶液には、どのような役割があるか。
⑫ 亜鉛板と銅板を用いた電池で、亜鉛板が負極になる理由を説明せよ。
⑬ イオン化傾向を比較して、鉄と銅ではどちらが錆びやすいか。
⑭ 電池のプラス極とマイナス極は、それぞれ電子を放出する側、電子を受け取る側のどちらか。
⑮ 電池の中で電子が移動する経路を答えよ。
⑯ 同じ金属を電極として用いても電流は発生しない。その理由を説明せよ。
⑰ イオン化傾向が高い金属は、一般的にどのような特徴を持つことが多いか、2つ答えなさい。
⑱ 電池の電圧を大きくするには、どのような金属の組み合わせを使えばよいか。
⑲ 塩化物イオンが電子を出して塩素分子になる変化を化学反応式で表しなさい。
⑳ 電池のプラス極で発生した塩素は、どのような性質を持つ?
解答と解説
① Mg > Zn > Fe > Cu
解説:イオン化傾向は、Mg(マグネシウム)>Zn(亜鉛)>Fe(鉄)>Cu(銅)の順に大きくなります。
② 電子を放出して陽イオンになりやすい性質
解説:イオン化傾向が大きい金属ほど、電子を手放して陽イオンになりやすい性質があります。
③ 水素(H₂)が発生する。銅板付近では、水素イオン(H⁺)が電子を受け取り、水素原子(H)となり、水素分子(H₂)として発生する。
④ 亜鉛板から銅板
解説:イオン化傾向の大きい亜鉛板から、イオン化傾向の小さい銅板に向かって電子が流れます。
⑤ イオン化傾向の差
解説:使用する金属のイオン化傾向の差が大きいほど、電池の電圧は大きくなります。
⑥ Na⁺(ナトリウムイオン)とCl⁻(塩化物イオン)
解説:食塩水はNaCl(塩化ナトリウム)の水溶液なので、Na⁺とCl⁻が存在します。
⑦ 化学電池
解説:2種類の金属を電解質水溶液に入れて電流を発生させる装置を、化学電池といいます。
⑧ 戻りやすく
解説:イオン化傾向の小さな金属は、陽イオンになりにくく、逆に還元されて原子になりやすい性質があります。
⑨ 発生させない
解説:水素イオンよりもイオン化傾向の小さい金属は、水素イオンよりも電子を受け取りにくいため、酸に溶けて水素を発生させることはありません。
⑩ 化学エネルギーを電気エネルギーに変換する装置。イオン化傾向の異なる2種類の金属を電解質溶液に浸し、導線でつなぐことで電子の流れを発生させる。
解説:電池は、化学反応によって発生する電子の流れを利用して、化学エネルギーを電気エネルギーに変換する装置です。
⑪ 電子の流れを助ける
解説:電解質溶液は、イオンを含んでおり、電子の流れを助ける役割があります。
⑫ 亜鉛の方が銅よりもイオン化傾向が大きいため
解説:亜鉛は銅よりもイオン化傾向が大きいため、電子を放出して亜鉛イオンになりやすく、負極となります。
⑬ 鉄
解説:鉄は銅よりもイオン化傾向が大きいため、酸化されやすく錆びやすいです。
⑭ プラス極:電子を受け取る側、マイナス極:電子を放出する側
解説:プラス極は電子を受け取る側、マイナス極は電子を放出する側です。
⑮ 負極 → 導線 → 正極 → 電解質溶液 → 負極
解説:電子は負極から導線を通って正極へ流れ、電解質溶液中ではイオンが移動することで電流が流れます。
⑯ イオン化傾向が同じため電位差が生じないから
解説:電池はイオン化傾向の差を利用して電圧を発生させるため、同じ金属では電位差が生じず、電流は発生しません。
⑰
- 金属光沢を持つ
- 水素よりもイオン化傾向が大きく、酸と反応して水素を発生する
解説:イオン化傾向の高い金属は、一般的に金属光沢を持ち、反応性が大きく、酸と反応して水素を発生させる特徴があります。
⑱ イオン化傾向の差が大きい金属
解説:イオン化傾向の差が大きい金属同士を組み合わせることで、電圧を大きくすることができます。
⑲ 2Cl⁻ → Cl₂ + 2e⁻
解説:塩化物イオンが電子を失うことで、塩素原子が結合して塩素分子になります。
⑳ 黄緑色の有毒な気体で、刺激臭を持つ。
解説:塩素は、特有の刺激臭を持つ黄緑色の気体で、毒性があります。
😊「なんだ。簡単じゃん」と感じてもらえたらすごくうれしいです。わかりにくい問題があったら、教えてください。簡単に説明したり、わかりやすい他の方法で、もっと楽に理解が深まります。
「ブログより実際に話しがしたい」「もっといろいろ教えてほしい!」と感じた人は、無料体験や相談に来てください! この先生に相談をすることや習うことができます! 少し勇気を出して、ぜひ一度体験しに来てください! 「わかるって面白い」とか成績が良くなる自分を感じられる日がきます。お問い合わせ・ご質問はこちらです。












