🔋 え、電池って金属でできてるの!?😱 イオン化傾向早見表でスッキリ解説! 🔋
みんな、スマホの充電切れたら超焦るよね?😣
ところで、その充電に欠かせない 電池 って、どうやって電気を作ってるか知ってる? 実は、みんながよく知ってる 金属 が大活躍してるんだ!
🤨 電池のヒミツは「イオン化傾向」!
金属って、実は「イオンになりたい!」っていうタイプと、「別にイオンでなくてもいいし~」っていうタイプがいるんだ。
この イオンになりやすさ のことを イオン化傾向 って言うんだけど、これが電池の仕組みを理解する上で超重要!🔑
イオン化傾向の順番はコレ! 👇
[イオン化傾向] 左側の方がイオンになりやすい。 電子を放しやすい。 (右側の方が、原子に戻りやすい)
Na Mg Al Zn Fe (H) Cu
<ナニ。 マジ ある 亜鉛 鉄 (H) 道>と覚えよ。
この順番、語呂合わせで覚えちゃおう!😉
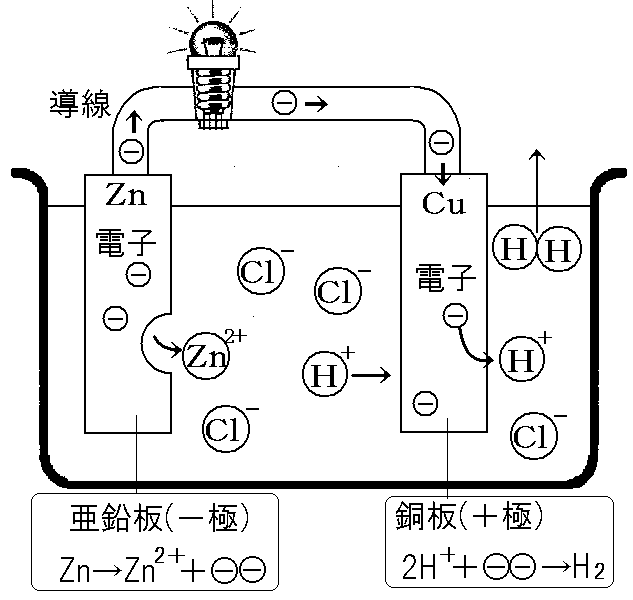
🧪 亜鉛と銅で電池を作ってみよう!
じゃあ、実際に 亜鉛 と 銅 を使って電池を作る実験を見てみよう!
- 亜鉛板と銅板を電解質溶液に入れる
- 電解質溶液っていうのは、電気を流す液体のこと!
- 亜鉛と銅、どっちがイオンになりやすいかな?🤔 そう! 亜鉛 だよね!
- 亜鉛が電子を放出!
- イオンになりたがりの亜鉛は、電子を放り出して亜鉛イオンになって溶液に溶け出す!
- 放り出された電子は亜鉛板に残って、亜鉛板はマイナスの電気を帯びるんだ。亜鉛板が陰極になる。
- この反応は、化学式で書くとこうなるよ!
亜鉛板:Zn → Zn²⁺ + 2e⁻
- 電子が銅板へ移動!
- 亜鉛板から放出された電子は、導線を通って銅板まで移動するぞ!🏃♂️💨
- 水素イオンが電子を受け取る!
- 銅板にたどり着いた電子は、溶液中の水素イオンとくっつく!
- 溶液中には亜鉛イオンもいるんだけど、イオン化傾向が高い 亜鉛イオンは、もう一回電子を受け取って金属に戻る気はあんまりない んだ。
- その点、水素イオンは喜んで電子を受け取ってくれるから、結果的に水素イオンが電子とくっつくことになるんだね!
- 水素が発生!
- 電子とくっついた水素イオンは、水素原子になって、さらにそれが2つくっついて水素分子になる!
- 水素分子は気体だから、プクプクと泡になって出てくるんだ!
- この反応も化学式で書くとこうだよ!
銅板:2H⁺ + 2e⁻ → H₂
✨まとめ✨
- 金属によってイオンになりやすさが違うことを イオン化傾向 っていうんだ!
- 電池は、この イオン化傾向の違い を利用して電気を作ってるんだね!
電池って、金属がイオンになったり、電子が移動したり、実はすごいことが起こってたんだね!😲
今度、電池を使うときに思い出してみてね!😄
動画でまとめ
電池の仕組み確認テスト!全問正解なるか!?
⚡️次の文中の()に当てはまる語句を選んでね!⚡️
① 電池に使われている金属の代表的なものは( )と( )である。
a. 金、銀 b. 鉄、アルミニウム c. 亜鉛、銅
② 金属がイオンになりやすい順番を( )という。
a. イオン化傾向 b. イオン化順序 c. イオン化列
③ イオン化傾向が大きい金属ほど、電子を( )。
a. 放出しやすい b. 放出しにくい c. 受け取りやすい
④ 亜鉛と銅では、イオン化傾向が大きいのは( )である。
a. 亜鉛 b. 銅 c. 同じ
⑤ 亜鉛板から溶け出した電子は、導線を通って( )に移動する。
a. 電解質溶液 b. 亜鉛板自身 c. 銅板
⑥ 銅板にやってきた電子を受け取るのは、溶液中の( )である。
a. 亜鉛イオン b. 水素イオン c. 水分子
⑦ 水素イオンが電子を受け取ると( )が発生する。
a. 酸素 b. 水素 c. 二酸化炭素
⑧ 亜鉛と銅の電池では最終的に、亜鉛と水素イオンが反応して( )と( )ができる。
a. 水素、銅イオン b. 亜鉛イオン、水素 c. 銅、水
⑨ イオン化傾向を表す順番を覚えるための語呂合わせを答えなさい。
⑩ 電池のプラス極とマイナス極を決めるのは、金属の何の違い?
a. 色 b. 重さ c. イオン化傾向
⚡️次の文章が正しい場合は〇、間違っている場合は×を選んでね!⚡️
⑪ イオン化傾向が小さい金属は、イオンになりやすい。
⑫ 亜鉛板と銅板の電池では、銅板から水素が発生する。
⑬ 電池は、化学反応を利用して電気エネルギーを取り出す装置である。
⑭ 電池のプラス極とマイナス極は、使う金属によって変わる。
⑮ イオン化傾向は、金属が電子を受け取る力の強さを表す。
⚡️次の化学反応式は何が起こっている?⚡️
⑯ Zn → Zn²⁺ + 2e⁻
a. 亜鉛イオンが電子を受け取って亜鉛原子になる。
b. 亜鉛原子が電子を放出して亜鉛イオンになる。
c. 水素イオンが電子を受け取って水素原子になる。
⑰ 2H⁺ + 2e⁻ → H₂
a. 亜鉛原子が電子を放出して亜鉛イオンになる。
b. 水素原子が電子を放出して水素イオンになる。
c. 水素イオンが電子を受け取って水素分子になる。
⑱ もし、銅板の代わりにマグネシウム板を使ったらどうなる?
a. 亜鉛板からマグネシウム板に電子が移動し、マグネシウム板から水素が発生する
b. マグネシウム板から亜鉛板に電子が移動し、亜鉛板から水素が発生する
c. 反応は起こらない
⚡️次の電池の仕組みを簡単に説明してください。⚡️
⑲ 電池の中で、電子はどちらの方向に移動している?
⑳ なぜ水素イオンは、亜鉛イオンではなく電子を受け取るのか?
電池の仕組み確認テスト!解答と解説
⚡️語句選択問題⚡️
① 解答:c. 亜鉛、銅
解説: 身近で使われているマンガン乾電池やアルカリ乾電池には、主に亜鉛と銅が使用されています。
② 解答: a. イオン化傾向
解説: イオン化傾向は、金属が水溶液中で陽イオンになりやすいかどうかを表す指標です。
③ 解答:a. 放出しやすい
解説: イオン化傾向が大きいということは、それだけプラスイオンになりたいタイプ!だから、電子を放出して陽イオンになりやすいのです。
④ 解答: a. 亜鉛
解説: 語呂合わせ「なにマジある亜鉛鉄道」で覚えられるように、亜鉛の方が銅よりもイオン化傾向が大きいです。
⑤ 解答:c. 銅板
解説: 電池の中では、電子はマイナス極からプラス極に向かって移動します。亜鉛板はマイナス極、銅板はプラス極なので、電子は亜鉛板から銅板へ移動します。
⑥ 解答:b. 水素イオン
解説: 水溶液中には亜鉛イオンも存在しますが、水素イオンの方がイオン化傾向が小さいため、電子を受け取って水素原子になろうとします。
⑦ 解答:b. 水素
解説: 水素イオン (H⁺) が電子を受け取ると、水素原子 (H) になります。水素原子は2つ結合して水素分子 (H₂) となり、気体として発生します。
⑧ 解答:b. 亜鉛イオン、水素
解説: 電池全体では、亜鉛が溶けて亜鉛イオンになり、水素イオンが電子を受け取って水素が発生するという反応が起こっています。
⑨ 解答:c. なにマジある亜鉛鉄道
解説: イオン化傾向は、金属元素と水素を含めて覚えると便利です。
⑩ 解答:c. イオン化傾向
解説: イオン化傾向が異なる2種類の金属を使うことで、電子のやり取りが発生し、電流が流れます。
⚡️正誤問題⚡️
⑪ 解答:×
解説: イオン化傾向が小さい金属は、イオンになりにくい性質があります。
⑫ 解答:〇
解説: 銅板に移動してきた電子を水素イオンが受け取って水素が発生します。
⑬ 解答:〇
解説: 電池は、化学エネルギーを電気エネルギーに変換する装置です。
⑭ 解答:〇
解説: イオン化傾向の大小によって、どちらがプラス極、マイナス極になるかが決まります。
⑮ 解答:×
解説: イオン化傾向は、金属が電子を放出して陽イオンになる力の強さを表します。
⚡️化学反応式問題⚡️
⑯ 解答:b. 亜鉛原子が電子を放出して亜鉛イオンになる。
解説: この式は、亜鉛原子が電子を失ってプラスの電荷を持つ亜鉛イオンになる反応を表しています。
⑰ 解答:c. 水素イオンが電子を受け取って水素分子になる。
解説: プラスの電荷を持つ水素イオンが電子を受け取って、電荷を持たない水素原子になり、さらにそれが2つ結合して水素分子になる反応を表しています。
⑱ 解答:b. マグネシウム板から亜鉛板に電子が移動し、亜鉛板から水素が発生する
解説: マグネシウムは亜鉛よりもイオン化傾向が大きいため、マグネシウム板がマイナス極、亜鉛板がプラス極となります。このため、電子はマグネシウム板から亜鉛板に移動し、亜鉛板上で水素が発生します。
⚡️記述問題⚡️
⑲ 解答:電池の中では、電子はマイナス極からプラス極に向かって移動している。
この電池の場合、亜鉛板から銅板に向かって移動する。
⑳ 解答:水素イオンは、亜鉛イオンよりもイオン化傾向が小さいため、電子を受け取りやすいから。
解説: つまり、水素イオンの方が、電子を受け取って原子に戻りたい力が強いということです。
これで完璧ですね!🙌✨
🔋 電池の世界を探検! いろんな電池の仕組み教えます!🔋
🔬ダニエル電池 🔬
理科の実験で「 ダニエル電池 」って聞いたことない?
これは、亜鉛板と銅板をそれぞれ異なる溶液に浸して導線でつなぐことで電気を起こす電池のこと!
- 亜鉛板側: 亜鉛板を硫酸亜鉛 (ZnSO₄) 水溶液に浸す。亜鉛はイオン化傾向が大きいため、電子を放出して溶け出し、亜鉛イオン (Zn²⁺) になる。 (反応式) Zn → Zn²⁺ + 2e⁻
- 銅板側: 銅板を硫酸銅 (CuSO₄) 水溶液に浸す。銅板の表面では、溶液中の銅イオン (Cu²⁺) が電子を受け取って銅原子 (Cu) となり、銅板上に析出する。 (反応式) Cu²⁺ + 2e⁻ → Cu
このように、ダニエル電池では、亜鉛板側で電子が放出され、導線を通って銅板側に移動することで電流が流れるんだ。
🪨 古いけどスゴイ!木炭電池!🪨
なんと、昔の人は 木炭 を使って電池を作っていたんだって!😳
「 木炭電池 」は、土の中に木炭と金属板を埋め込むことで電気を発生させる仕組み。
- 材料:備長炭(炭素C)、濃い食塩水で湿らせたろ紙、アルミニウム箔
- 仕組み:
- アルミニウムがイオン化傾向の高さから電子を放出して溶け出し、陽イオン (Al³⁺) になる。
(反応式) Al → Al³⁺ + 3e⁻ - 発生した電子は導線を通って備長炭へ流れる。
- 備長炭自体はイオン化しないが、電気を流す役割を果たす。
- 電子を受け取った備長炭側では、食塩水中の成分などが反応する。
- アルミニウムがイオン化傾向の高さから電子を放出して溶け出し、陽イオン (Al³⁺) になる。
- 結果:アルミニウム側がー極、備長炭側が+極となり、電流が流れる。
- 特徴:
- アルミニウムが化学変化を起こして電気を発生させる。
- 電流を流すとアルミニウム箔はボロボロになる。
現代では、木炭電池は実用的なエネルギー源としてはあまり使われていないけど、昔の人の知恵を感じることができるよね!

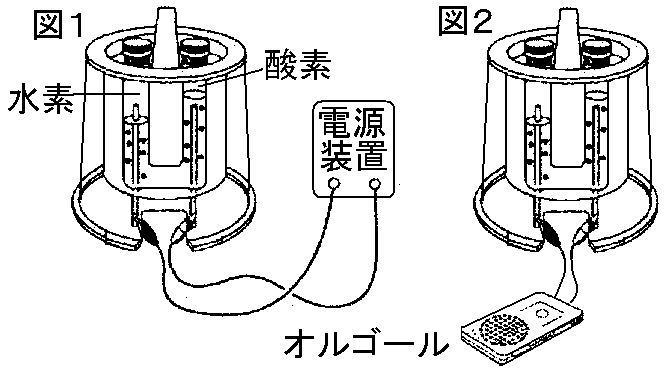
🔥 未来の電池!?燃料電池!🔥
最近よく耳にする「 燃料電池 」って知ってる?
これは、水素などの燃料を化学反応させて電気エネルギーを取り出す、とってもクリーンな電池なんだ!
- 仕組み:
- 水素と酸素を反応させて電気エネルギーと水を生み出す。
- 水の電気分解と逆の反応を利用している。
- 反応式:
- 負極反応: 2H₂ → 4H⁺ + 4e⁻
- 正極反応: O₂ + 4H⁺ + 4e⁻ → 2H₂O
- 全体反応: 2H₂ + O₂ → 2H₂O
- 特徴:
- 水素と酸素を供給し続けることで発電できる。
- 排出物は水のみで、クリーンなエネルギー源。
燃料電池は、水素社会実現のカギとなる技術として、世界中で研究開発が進められているんだ!
🔌 繰り返し使える?使えない?一次電池と二次電池 🔌
電池には、大きく分けて「 一次電池 」と「 二次電池 」の2種類があるんだ。
- 一次電池: 使い捨ての電池で、一度使うと充電できない。マンガン乾電池やアルカリ乾電池など、私たちの身の回りでよく使われているよ!
- 二次電池: 充電して繰り返し使える電池!スマホやパソコンなどに使われているリチウムイオン電池が代表的!
最近では、環境問題への意識の高まりから、繰り返し使える二次電池が注目されているね!
😊「なんだ。簡単じゃん」と感じてもらえたらすごくうれしいです。わかりにくい問題があったら、教えてください。簡単に説明したり、わかりやすい他の方法で、もっと楽に理解が深まります。
「ブログより実際に話しがしたい」「もっといろいろ教えてほしい!」と感じた人は、無料体験や相談に来てください! この先生に相談をすることや習うことができます! 少し勇気を出して、ぜひ一度体験しに来てください! 「わかるって面白い」とか成績が良くなる自分を感じられる日がきます。お問い合わせ・ご質問はこちらです。












