みんな! ~電子の行方を追え!~
みんなこんにちは! 今日は理科の授業で習う「電気分解」を、わかりやすく解説するよ!
電気分解って何か、電子の動きに注目しながら解き明かしていこう!
第一話:塩酸が大変身!?水素と塩素の正体とは!
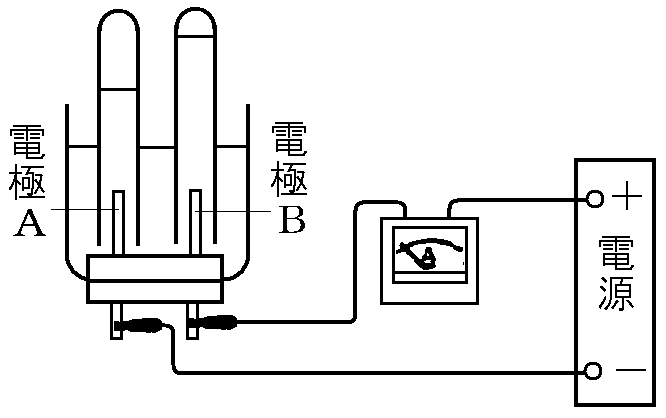
まずは塩酸を使った実験からスタート!
塩酸に電気を流すと、あら不思議! 水素と塩素が発生するんだ! なんでこんなことが起きるのか、電子の動きを追跡だ!
1. 電子の旅立ち:陰極を出発!
電池のマイナス極から電子がいっぱい出発! 電線を通って電極(陰極)に到着!
2. 陰極での出会い:水素イオンと電子のカップル誕生!
塩酸の中には水素イオン(H⁺)くんがいるんだけど、プラスの電気を帯びているから、マイナスの電気を帯びた陰極に引き寄せられるんだ!
そこで!水素イオン(H⁺)くんは電子(e⁻)ちゃんと出会って、なんと水素原子(H)に変身! さらに水素原子(H)同士が手を繋いで、水素分子(H₂)になって、気体となって発生するんだ!
2H⁺ + 2e⁻ → H₂↑
3. 電子のバトンリレー:イオンが繋ぐ電流の道!
塩化物イオン(Cl⁻)ちゃんは陰イオンだから、陽極へ移動。 水素イオン(H⁺)くんは陰極へと移動することで、水溶液の中を電流が流れるんだ! まるでバトンリレーみたいだね!
4. 陽極での別れ:塩化物イオン、電子の別れ!
塩化物イオン(Cl⁻)ちゃんは、マイナスの電気を帯びているから、プラスの電気を帯びた陽極に引き寄せられます。
陽極で、塩化物イオン(Cl⁻)ちゃんは電子(e⁻)ちゃんと別れ、塩素原子(Cl)に変身!塩素原子(Cl)同士が手を繋いで、塩素分子(Cl₂)になって、気体となって発生するんだ!
2Cl⁻ → Cl₂↑ + 2e⁻
塩素は、プールの消毒剤のようなツンとした匂いがする黄緑色の気体だよ。実験では、気体を直接吸い込まないように気をつけようね!
5. 電子の終着駅:陽極に到着!
塩化物イオン(Cl⁻)ちゃんと別れた電子(e⁻)ちゃんは、陽極から電線を通って電池のプラス極へと帰っていくよ。
6. 電子の流れと電流の流れ:逆方向だって!?
実は電子の流れと電流の流れは逆方向なんだ!
電子は陰極→陽極に移動するけど、電流は陽極→陰極に流れるんだね!
7. 電気分解のゆくえ:イオンが減って…どうなる!?
電気分解が進むと、水素イオン(H⁺)くんと塩化物イオン(Cl⁻)ちゃんはどんどん減っていくんだ。
イオンが減ると、電流が流れにくくなって、電気分解の反応も進みにくくなるんだ。
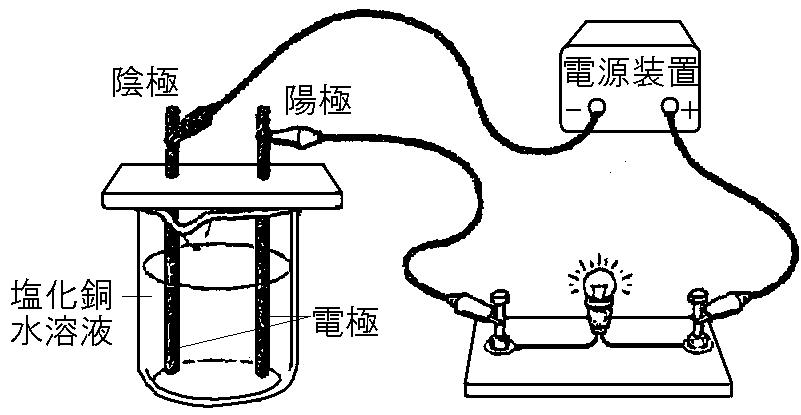
第二話:青い水溶液の謎!銅イオンはどこへ消えた!?
次は塩化銅水溶液を使った実験に挑戦!
塩化銅水溶液に電気を流すと…今度はなんと!陰極に銅が析出して、陽極からは塩素が発生するんだ!
一体何が起こっているのか、電子の動きを詳しく見てみよう!
塩化銅水溶液は、とっても綺麗な青色をしているんだ。 これは、銅イオン(Cu²⁺)くんが青色だからです。中学校で習うイオンで色がついているのは、銅イオン(Cu²⁺)くんの青だけです。
1. 電子の旅立ち:陰極がスタート地点!
塩酸の時と同じように、電池のマイナス極から電子がいっぱい出発! 電線を通って陰極に到着!
2. 陰極での再会:銅イオンと電子のラブストーリー!?
今度は水溶液の中に銅イオン(Cu²⁺)くんが登場!
銅イオン(Cu²⁺)くんはプラスの電気を帯びているから、マイナスの電気を帯びた陰極に一目惚れ!
陰極で、銅イオン(Cu²⁺)くんは電子(e⁻)ちゃんと2個も出会って、なんと銅原子(Cu)に変身!
そして電極にくっ付きます。これを付着すると言うんだ! 銅は磨くと光ます。金属光沢があると言います。色は新しい10円玉の色を想像してください。時々、問題では新しい10円玉の色をなんと「赤」と書いてある場合もあります。気を付けてください。
Cu²⁺ + 2e⁻ → Cu
3. 電子のバトンリレー:イオンが繋ぐ電流の道!
塩化物イオン(Cl⁻)ちゃんは陽極へ、銅イオン(Cu²⁺)くんは陰極へと移動して、水溶液の中に電流が流れる!ここでもバトンリレーは大活躍!
4. 陽極での別れ:塩化物イオン、再び電子の別れ!
塩酸の時と同じように、塩化物イオン(Cl⁻)ちゃんは陽極で電子(e⁻)ちゃんと別れ、塩素分子(Cl₂)になって気体となって発生するんだ!
2Cl⁻ → Cl₂↑ + 2e⁻
塩素は、プールの消毒剤のようなツンとした匂いがする黄緑色の気体だよ。実験では、気体を直接吸い込まないように気をつけようね!
5. 電子の終着駅:陽極に到着!
塩化物イオン(Cl⁻)ちゃんと別れた電子(e⁻)ちゃんは、陽極から電池のプラス極へと帰って行きます。
6. 電子の流れと電流の流れ:やっぱり逆方向!
塩酸の時と同様、電子の流れは陰極→陽極、電流の流れは陽極→陰極と逆方向なんだ!
7. 電気分解の結末:青色の水溶液の秘密!
電気分解が進むと、水溶液を青色にしている銅イオン(Cu²⁺)くんはどんどん減っていくから、水溶液の青色はだんだん薄くなっていくんだ。
塩化物イオン(Cl⁻)ちゃんも減っていくから、電流が流れにくくなって、反応が進みにくくなるんだね。
どうだったかな?
電子の動きを追跡すると、塩酸や塩化銅水溶液の電気分解がわかりやすくなります!
電子の動きは目に見えないけど、電気分解を通してその働きを体感することができるんだ!
これからも身の回りの現象に隠された電子の秘密を探求していこう!
動画でまとめ
電気分解マスターへの道!⚡️ 確認テスト
問題1:塩酸の場合
① 電源のプラス極から出てきた電子は、最終的にどちらの電極にたどり着く?
a) 陰極 b) 陽極
② 塩酸の中にいる水素イオン(H⁺)は、どちらの電極に引き寄せられる?
a) 陰極 b) 陽極
③ 陰極で水素イオン(H⁺)はどうなる?
a) 電子を受け取って水素原子になる b) 電子を渡して水素原子になる
④ 塩酸の中にいる塩化物イオン(Cl⁻)は、どちらの電極に引き寄せられる?
a) 陰極 b) 陽極
⑤ 陽極で塩化物イオン(Cl⁻)はどうなる?
a) 電子を受け取って塩素原子になる b) 電子を渡して塩素原子になる
問題2:塩化銅水溶液の場合
① 電源のマイナス極から出てきた電子は、最終的にどちらの電極にたどり着く?
a) 陰極 b) 陽極
② 塩化銅水溶液の中にいる銅イオン(Cu²⁺)は、どちらの電極に引き寄せられる?
a) 陰極 b) 陽極
③ 陰極で銅イオン(Cu²⁺)はどうなる?
a) 電子を受け取って銅原子になる b) 電子を渡して銅原子になる
④ 塩化銅水溶液の中にいる塩化物イオン(Cl⁻)はどちらの電極に引き寄せられる?
a) 陰極 b) 陽極
⑤ 陽極で塩化物イオン(Cl⁻)はどうなる?
a) 電子を受け取って塩素原子になる b) 電子を渡して塩素原子になる
問題3:さらに理解を深めよう!
① 塩酸の電気分解と塩化銅水溶液の電気分解で、共通して発生する気体は?
② 電子の流れと電流の流れる向きは?
a) 同じ向き b) 逆向き
電気分解マスターへの道!⚡️ 解答
問題1:塩酸の場合
① b) 陽極
② a) 陰極
③ a) 電子を受け取って水素原子になる
④ b) 陽極
⑤ b) 電子を渡して塩素原子になる
問題2:塩化銅水溶液の場合
① b) 陽極
② a) 陰極
③ a) 電子を受け取って銅原子になる
④ b) 陽極
⑤ b) 電子を渡して塩素原子になる
問題3:さらに理解を深めよう!
① 塩素
② b) 逆向き
解説
- 電子の動きは、電源のマイナス極からプラス極へと向かいます。
- 電流の向きは電子の動きとは逆で、プラス極からマイナス極へと流れると定義されています。
- 陰極では電子を受け取る反応、陽極では電子を渡す反応が起こります。









-min-300x158.jpg)